| □ H15年12月期 A-17 Code:[HG0703] : ニッケルカドミウム蓄電池(ニッカド電池)の構造と特性 |
 検索サイトから来た方は… 無線工学の基礎 トップへ 以下をクリックすると、元のページが行き先に飛び、このウインドウは閉じます |
| ■ 無線工学を学ぶ |
|
(1) 無線工学の基礎 |
|
年度別出題一覧 |
| H11年 4月期,8月期,12月期 |
| H12年 4月期,8月期,12月期 |
| H13年 4月期,8月期,12月期 |
| H14年 4月期,8月期,12月期 |
| H15年 4月期,8月期,12月期 |
| H16年 4月期,8月期,12月期 |
| H17年 4月期,8月期,12月期 |
| H18年 4月期,8月期,12月期 |
| H19年 4月期,8月期,12月期 |
| H20年 4月期,8月期,12月期 |
| H21年 4月期,8月期,12月期 |
| H22年 4月期,8月期,12月期 |
| H23年 4月期,8月期,12月期 |
| H24年 4月期,8月期,12月期 |
| H25年 4月期,8月期,12月期 |
| H26年 4月期,8月期,12月期 |
| H27年 4月期,8月期,12月期 |
| H28年 4月期,8月期,12月期 |
| H29年 4月期,8月期,12月期 |
| H30年 4月期,8月期,12月期 |
| R01年 4月期,8月期,12月期 |
| R02年 4月期,9月期,12月期 |
| R03年 4月期,9月期,12月期 |
| R04年 4月期,8月期,12月期 |
| R05年 4月期,8月期,12月期 |
| R06年 4月期,8月期,12月期 |
|
分野別出題一覧 |
| A 電気物理, B 電気回路 |
| C 能動素子, D 電子回路 |
| E 送信機, F 受信機 |
| G 電源, H アンテナ&給電線 |
| I 電波伝搬, J 計測 |
| ■ サイトポリシー |
| ■ サイトマップ[1ama] |
| ■ リンクと資料 |
■ メールは下記まで |

|
| 2025年 |
| 03/31 R06/12月期問題頁掲載 |
| 03/31 R06/08月期問題頁掲載 |
| 03/31 R06/04月期問題頁掲載 |
| 03/31 R05/12月期問題頁掲載 |
| 03/31 R05/08月期問題頁掲載 |
| 03/31 R05/04月期問題頁掲載 |
|
|
| |||||||||||||||||||||
| |||||||||||||||||||||
| |||||||||||||||||||||
ニッケルカドミウム電池は、「ニカド電池(JIS)」「ニッカド電池」「カドニカ(三洋電機の商標名)」とか呼ばれるもので、ハンディ機などの電源としてよく使われていました。[1]ニッケルカドミウム電池の概要上の文章が過去形なのは、最近多く使われるようになった、ニッケル水素電池にその座を明け渡しつつあるからです。ニッケル水素の方が容量が大きく、カドミウムという環境負荷の大きな材料を使わないためですが、まだ現役で使われています。放電された状態では、負極が水酸化カドミウム(以下、Cd(OH)2)、正極が水酸化ニッケル(以下、Ni(OH)2)になっています。充電すると、負極がカドミウム(以下、Cd)、正極がオキシ水酸化ニッケル(以下、NiOOH)に変化します。電解液は、水酸化カリウムや水酸化ナトリウムなどの水溶液です。 では、その化学変化を詳しく見て行きます。 [2]動作原理その1…充電時まず、負極では、水酸化カドミウムが金属のカドミウムになります。 | |
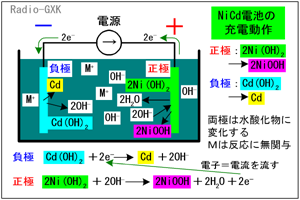 Fig.HG0703_a ニッカド電池の動作原理…充電時 |
Cd(OH)2+2e- → Cd+2OH- …(1) (1)の反応式右辺の2OH-はイオンですから、水に溶けます。一方、正極では、水酸化ニッケルがオキシ水酸化ニッケル、という聞きなれない物質に変化します。 2Ni(OH)2+2OH- → 2NiOOH+2H2O+2e- …(2) (2)式左辺の2OH-は、(1)式の右辺に生成したものをもらってきた、と考えてもいいでしょう。反応式は反応式として、定性的には、 |
|
・負極にはカドミウムが、正極にはオキシ水酸化ニッケルが生成する ・充電により水が生成するので、電解液の濃度は薄くなる 上で、電解液は水酸化カリウムや水酸化ナトリウムなどのアルカリ溶液だ、と書きましたが、電解液の金属イオン(K+やNa+)は、電池の反応に関与しません。かと言って、これらは何でもいいわけではなくて、イオン化傾向(電子を外に出してイオンになる容易度)が電極を構成する金属よりも大きくなければなりません。 [3]動作原理その2…放電時 | |
|
一方、放電時は充電と逆の反応になります。負極では、電解液中の水酸化物イオンとカドミウムが反応して Cd+2OH- → Cd(OH)2+2e- …(3) となって、水酸化カドミウムが生成するとともに、電子が発生します。また、正極ではオキシ水酸化ニッケルと水が、負極から流れてきた電子により、 2NiOOH+2H2O+2e- → Ni(OH)2+2OH- …(4) となって水酸化ニッケルとなります。要約すると、 |
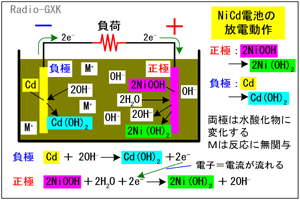 Fig.HG0703_b ニカド電池の動作原理…放電時 |
|
・負極には水酸化カドミウムが、正極には水酸化ニッケルが生成する ・放電により水が消費されるので、電解液の濃度は上がる ということになります。 [4]ニッケルカドミウム電池の特徴よく使われていたので、ご存知の方も多いでしょうが、改めて見ておきましょう。まずは長所です。 ・電圧は約1.2 [V]…乾電池に近い電圧(乾電池が公称電圧の1.5 [V]なのはごく最初だけで後は1.3〜1.2 [V]に下がる)なので、ほぼ互換です。また、放電電流にもよりますが、他の充電池よりも放電中の電圧が一定に保たれている時間が長い特性があります。 ・内部抵抗が低い…大電流を流しても、端子電圧が下がりにくい特徴を持っています。 ・繰り返し使用に強い…300〜500回も充放電を繰り返すことができます。 ・過放電・過充電に強い…かなり電圧が下がるまで過放電させても鉛蓄電池のように電池としての機能が失われることはほとんどありません。 次に短所です。 ・メモリー効果がある…完全に放電させずに「継ぎ足し充電」を繰り返すと、容量が減少したようになります。 ・低温に弱い…低温では、取り出せる電荷量が大きく減少します。常温に戻すと復活します。 ・環境負荷が大きい…カドミウムを含むので、リサイクル体制の確立が必要。ゴミとして排出されると有害物となります。 それでは、解答に移ります。 A…ニカド電池の負極(陰極)はカドミウムです B…ニカド電圧の公称電圧は1.2 [V]です C…アルカリ蓄電池は過充電や過放電に強い電池です となりますから、正解は1と分かります。 ちなみに、[正極][負極]は電池の用語ですが、[陽極][陰極]は電気分解(あるいはメッキなど)電源を用いて化学変化を起こす場合の用語です。充電式電池の場合、正確には、電池を電源として用いる時は[正極][負極]ですが、充電の場合は[陽極][陰極]となりますが、要するに電池の+極と−極のことですので、あまりこだわる必要はないでしょう。 | |
 |
 |