| □ H16年04月期 A-17 Code:[HG0702] : 様々な電池の名称と、一次/二次の別、公称電圧 |
 検索サイトから来た方は… 無線工学の基礎 トップへ 以下をクリックすると、元のページが行き先に飛び、このウインドウは閉じます |
| ■ 無線工学を学ぶ |
|
(1) 無線工学の基礎 |
|
年度別出題一覧 |
| H11年 4月期,8月期,12月期 |
| H12年 4月期,8月期,12月期 |
| H13年 4月期,8月期,12月期 |
| H14年 4月期,8月期,12月期 |
| H15年 4月期,8月期,12月期 |
| H16年 4月期,8月期,12月期 |
| H17年 4月期,8月期,12月期 |
| H18年 4月期,8月期,12月期 |
| H19年 4月期,8月期,12月期 |
| H20年 4月期,8月期,12月期 |
| H21年 4月期,8月期,12月期 |
| H22年 4月期,8月期,12月期 |
| H23年 4月期,8月期,12月期 |
| H24年 4月期,8月期,12月期 |
| H25年 4月期,8月期,12月期 |
| H26年 4月期,8月期,12月期 |
| H27年 4月期,8月期,12月期 |
| H28年 4月期,8月期,12月期 |
| H29年 4月期,8月期,12月期 |
| H30年 4月期,8月期,12月期 |
| R01年 4月期,8月期,12月期 |
| R02年 4月期,9月期,12月期 |
| R03年 4月期,9月期,12月期 |
| R04年 4月期,8月期,12月期 |
| R05年 4月期,8月期,12月期 |
| R06年 4月期,8月期,12月期 |
|
分野別出題一覧 |
| A 電気物理, B 電気回路 |
| C 能動素子, D 電子回路 |
| E 送信機, F 受信機 |
| G 電源, H アンテナ&給電線 |
| I 電波伝搬, J 計測 |
| ■ サイトポリシー |
| ■ サイトマップ[1ama] |
| ■ リンクと資料 |
■ メールは下記まで |

|
| 2025年 |
| 03/31 R06/12月期問題頁掲載 |
| 03/31 R06/08月期問題頁掲載 |
| 03/31 R06/04月期問題頁掲載 |
| 03/31 R05/12月期問題頁掲載 |
| 03/31 R05/08月期問題頁掲載 |
| 03/31 R05/04月期問題頁掲載 |
|
|
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
|
手軽な移動運用には電池(バッテリー)は必須です。普通、使い捨ての一次電池より充電で再利用できる二次電池の方がよく利用されますし、国家試験の出題としても、二次電池の出題が圧倒的です。 そうは言っても、選択肢の中には一次電池の用語なども紛れ込んでいますので、まず最初に一次電池について簡単にまとめた後、二次電池の種類ごとに調べて行きましょう。 [1]一次電池のまとめ一口に一次電池と言っても、様々な種類があります。最近よく使われるアルカリマンガン電池、バックアップに使われるリチウム電池等等です。
環境負荷が大きい(いわゆる「地球に優しくない」)水銀を含むことでほとんど使われなくなった「水銀電池」は除いています。 [2]鉛蓄電池の特徴と動作二次電池の代表格とも言える、鉛蓄電池の動作と特徴を説明します。下のFig.HG0702_aを見て下さい。予備知識として先に書いておきます。鉛蓄電池は100%充電された状態では、その電極が負極の鉛(以下、Pb)と正極の酸化鉛(以下、PbO2)からなっていて、放電が進んだ状態では両極ともその表面に硫酸鉛(以下、PbSO4)が多く生成します。電解液は、硫酸(H2SO4)です。硫酸は、実際は水で希釈した希硫酸で、水素イオン(以下H+)と硫酸イオン(以下SO42-)に分かれています。 | ||||||||||||||||||||||||||||||||||||
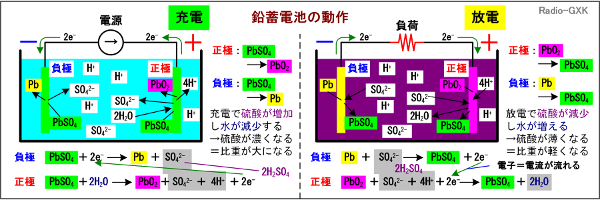 Fig.HG0702_a 鉛蓄電池の動作原理 | ||||||||||||||||||||||||||||||||||||
[3]ニッケルカドミウム電池(NiCd電池)の特徴と動作ニッケルカドミウム電池は、「ニカド電池(JIS)」「ニッカド電池」「カドニカ(三洋電機の商標名)」とか呼ばれるもので、ハンディ機などの電源としてよく使われていました。過去形なのは、この後に出てくる、ニッケル水素電池にその座を明け渡しつつあるからです。ニッケル水素の方が容量が大きく、カドミウムという環境負荷の大きな材料を使わないためですが、まだ現役で使われています。放電された状態では、負極が水酸化カドミウム(以下、Cd(OH)2)、正極が水酸化ニッケル(以下、Ni(OH)2)になっています。充電すると、負極がカドミウム(以下、Cd)、正極がオキシ水酸化ニッケル(以下、NiOOH)に変化します。電解液は、水酸化カリウムや水酸化ナトリウムなどの水溶液です。Fig.HG0702_bで動作を見ておきます。 | ||||||||||||||||||||||||||||||||||||
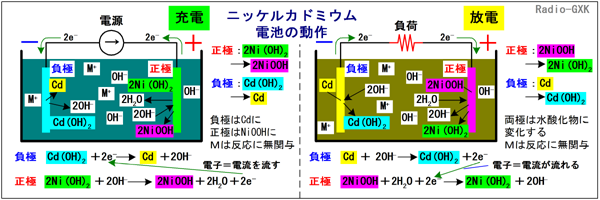 Fig.HG0702_b ニッケルカドミウム電池の動作原理 | ||||||||||||||||||||||||||||||||||||
[4]ニッケル水素電池(NiMH電池)の特徴と動作ニッケル水素電池は、(ニカド電池に比べて)容量が大きくカドミウムという環境負荷物質を使わないので、広く使われるようになってきました。動作は、電解液にアルカリ溶液を使うニカド電池と似ていますが、その名の通り、活性物質としてニッケルと水素を使うのですが、水素は金属ではないので、「電極」としては使えません。電極にするには「ある工夫」が必要になります。その工夫が、「水素吸蔵合金」と呼ばれるもので、金属の中に水素を取り込んでしまう、という不思議な性質を持ったものです。それでは、動作原理をFig.HG0702_cに示します。電解液は、水酸化ナトリウムまたは水酸化カリウムで、ニカドと同じです。 図の中では、水素吸蔵合金はMという記号で示します。 | ||||||||||||||||||||||||||||||||||||
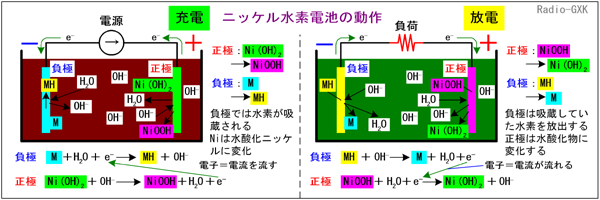 Fig.HG0702_c ニッケル水素電池の動作原理 | ||||||||||||||||||||||||||||||||||||
[5]リチウムイオン電池の特徴と動作近年、ノートPCや携帯電話などに多く用いられるようになった電池です。軽量で容量が大きいため、これらの機器で長時間駆動ができますが、一旦(電池内部で)短絡事故になった場合に放出されるエネルギーも大きいので、電池自体に保護回路が入っているのが普通で、単体では販売されていません。また、充電制御も必要なため、必ず機器の付属品として充電器が付いてくるか、あるいは充電器内蔵として、その機器専用に使われます。リチウムイオン電池は、他の二次電池と充放電の原理が少し違い、化学反応式で書くのが適当か分かりませんが、世間で採用されている表現で書いてみます。Fig.HG0702_dを見て下さい。 一般的なリチウムイオン電池では、正極にはコバルト酸リチウム(LiCoO2)、負極にはリチウムイオンを取込む特殊な構造をしたカーボン(C:炭素)、電解液には有機溶媒が用いられます。正極と負極の間には、セパレータと呼ばれる、リチウムイオンは通すが絶縁性のある膜が用いられ、正極と負極がショートしないようにしています。 | ||||||||||||||||||||||||||||||||||||
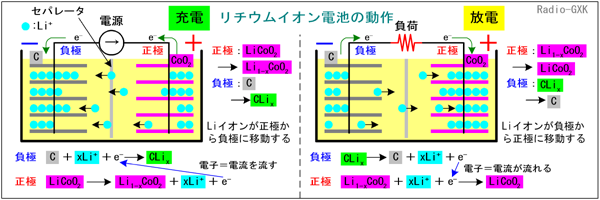 Fig.HG0702_d リチウムイオン電池の動作原理 | ||||||||||||||||||||||||||||||||||||
[6]二次電池のまとめ長々と説明してきましたが、国家試験が目的なら、下記のことをチェックしておけばよいでしょう。
| ||||||||||||||||||||||||||||||||||||
|
それでは、解答に移ります。 A…二次電池は鉛蓄電池です B…マンガン電池の公称電圧は1.5 [V]です C…ニカド電池の公称電圧は1.2 [V]です となりますから、正解は4と分かります。 | ||||||||||||||||||||||||||||||||||||
 |
 |
|||||||||||||||||||||||||||||||||||