| □ H16年08月期 A-18 Code:[HG0701] : 鉛蓄電池の電圧(公称、放電終止電圧)、又は、充放電と電解液の比重の変化 |
 検索サイトから来た方は… 無線工学の基礎 トップへ 以下をクリックすると、元のページが行き先に飛び、このウインドウは閉じます |
| ■ 無線工学を学ぶ |
|
(1) 無線工学の基礎 |
|
年度別出題一覧 |
| H11年 4月期,8月期,12月期 |
| H12年 4月期,8月期,12月期 |
| H13年 4月期,8月期,12月期 |
| H14年 4月期,8月期,12月期 |
| H15年 4月期,8月期,12月期 |
| H16年 4月期,8月期,12月期 |
| H17年 4月期,8月期,12月期 |
| H18年 4月期,8月期,12月期 |
| H19年 4月期,8月期,12月期 |
| H20年 4月期,8月期,12月期 |
| H21年 4月期,8月期,12月期 |
| H22年 4月期,8月期,12月期 |
| H23年 4月期,8月期,12月期 |
| H24年 4月期,8月期,12月期 |
| H25年 4月期,8月期,12月期 |
| H26年 4月期,8月期,12月期 |
| H27年 4月期,8月期,12月期 |
| H28年 4月期,8月期,12月期 |
| H29年 4月期,8月期,12月期 |
| H30年 4月期,8月期,12月期 |
| R01年 4月期,8月期,12月期 |
| R02年 4月期,9月期,12月期 |
| R03年 4月期,9月期,12月期 |
| R04年 4月期,8月期,12月期 |
| R05年 4月期,8月期,12月期 |
| R06年 4月期,8月期,12月期 |
|
分野別出題一覧 |
| A 電気物理, B 電気回路 |
| C 能動素子, D 電子回路 |
| E 送信機, F 受信機 |
| G 電源, H アンテナ&給電線 |
| I 電波伝搬, J 計測 |
| ■ サイトポリシー |
| ■ サイトマップ[1ama] |
| ■ リンクと資料 |
■ メールは下記まで |

|
| 2025年 |
| 03/31 R06/12月期問題頁掲載 |
| 03/31 R06/08月期問題頁掲載 |
| 03/31 R06/04月期問題頁掲載 |
| 03/31 R05/12月期問題頁掲載 |
| 03/31 R05/08月期問題頁掲載 |
| 03/31 R05/04月期問題頁掲載 |
|
|
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
鉛蓄電池(バッテリー)はモバイル機器にリチウムイオン電池が全盛のこの時代にあって、単位重量(or体積)あたりの容量も低いものですが、その歴史と安価な利点で、まだまだ現役です。その原理は電池の元祖、ともいえるもので、しばしば出題されていますので、よく理解しておきましょう。[1]鉛蓄電池を充電するとまず、基本知識として、鉛蓄電池は「二次電池」という分類に入ります。マンガン乾電池やアルカリ電池など、充電して再利用できないものを一次電池、鉛蓄電池や、リチウムイオン電池など、充電して再利用できるものを二次電池といいます。どの電池も化学反応で起電力を得ます(正確には、リチウムイオン電池は化学反応ではない)が、二次電池は「可逆反応」を用いなければ実現できません。要するに、充電と放電で、化学反応が逆に進行する仕組みになっています。鉛蓄電池はその電極が、100%充電された状態で、鉛(以下、Pb)と、酸化鉛(以下、PbO2)からなっていて、放電が進んだ状態では硫酸鉛(以下、PbSO4)が両極に多く生成します。電解液は、硫酸(H2SO4)です。硫酸は、実際は水で希釈した希硫酸で、水素イオン(以下H+)と硫酸イオン(以下SO42-)に分かれています。 電池にある程度の化学的知識は必要なのですが、あまり難しく考えず「電流は電子の流れ」・「負イオンから電子が放出されて元の原子(または分子)に」・「正イオンに電子が結合して元の原子(または分子)に」という、簡単な原理に基づいて考えて行きましょう。 | |
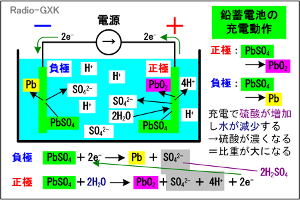 Fig.HG0701_a 鉛蓄電池の動作原理…充電時 |
まず、鉛蓄電池を充電する時のことを考えます。Fig.HG0701_a左を見て下さい。充電の時は、電源の+に電池の+を、電源の−を電池の−に、それぞれ接続します。通常、一定電流で充電します。 放電が進んだ鉛蓄電池は、両方の電極にPbSO2が多く生成しています(この後の「放電」の項参照)。負極では電源によって、電子が流し込まれます。この電子は、負極のPbSO4を電気分解して、 PbSO4+2e- → Pb+SO42- …(1) |
|
という反応が生じます。ここでPbは金属の鉛で電極に析出します。一方、SO42-はイオンですので、電解液中に溶け込みます。 次に、正極での反応を見てみましょう。正極でも負極同様にPbSO4が電極に生成していますが、これが水と反応し、電源により電子を引き剥がされて、 PbSO4+2H2O → PbO2+SO42-+4H-+2e- …(2) という反応が起こります。 ここで、化学反応式よりも重要なことに注意しましょう。それは、(1)(2)式から分かることですが、充電に伴い、 ・正極には酸化鉛が生成し、負極には鉛が生成する ・電解液中に硫酸の濃度が増加する ということです。また、以下のことも重要です。 ・十分に充電された鉛蓄電池の単位電池の電圧は約2.0 [V] ・硫酸濃度の増加と共に電解液の比重も増加し、満充電時の比重は1.2〜1.3 要するに、充電すると電極が酸化鉛と鉛に変化し、電解液の硫酸濃度が上がる、ということです。 では、満充電以降も電圧をかけ続けたらどうなるでしょうか? よく知られているように、鉛蓄電池を充電し続けると、「泡」が出てきます。この泡は、それぞれ水素(負極)と酸素(正極)で、早い話が水の電気分解になります。水素と酸素が混ざって出てくるので、非常に危険です。満充電にするためにはある程度この「泡」が出始めてからも電流を流し続ける必要があります(局部的に見るとまだPbO2が残っている)が、この間は火気は近づけないようにしなければなりません。 [2]鉛蓄電池を放電すると今度は逆に、鉛蓄電池を放電させる時のことを考えてみましょう。Fig.HG0701_bを見て下さい。 | |
|
負極では、鉛と硫酸が反応して電子を押し出そうとして下記のような反応が起こります。 Pb+SO42- → PbSO4+2e- …(3) 一方、正極では、負極から流れてきた電子を受け入れて、PbO2と硫酸が反応して、下記のような反応が起こります。 PbO2+SO42-+4H++2e- → PbSO4+2H2O …(4) ここでも、化学反応式よりも重要なことに注意しましょう。(3)(4)式から、放電に伴い、 |
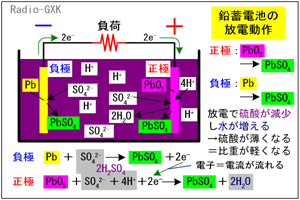 Fig.HG0701_b 鉛蓄電池の動作原理…放電時 |
|
・正極も負極も硫酸鉛が生成する ・電解液中に硫酸の濃度が減少し、代わりに水が生成される ということです。また、定量的な数値として以下のことも重要です。 ・電池として性能を保ちうる鉛蓄電池の放電終止電圧は約1.8 [V] ・硫酸濃度の減少と共に電解液の比重も減少し、放電終止時の比重は1.1前後 まとめると、放電すると両電極が硫酸鉛に変化し、電解液の硫酸濃度が下がる、ということです。 電圧が1.8 [V]を下回ってもなお放電し続けたらどうなるでしょうか? この場合、両方の電極が完全に硫酸鉛になってしまい、電位差は0 [V]となってしまいます。こうなったら、もう充電できませんから、電池として使えなくなります。 ここまで行かなくとも、普通の自動車のバッテリーは、公称容量の3〜4割まで使ったら、充電しないと危険です。6セルあるうちのどれかがばらつきにより先に死んでしまうと、全体が使い物にならなくなってしまうからです。バッテリーは生もので、なかなか扱いづらい面があります。 なお、他の二次電池の大半は、ほぼ満充電でずっと使っていると、メモリー効果(NiCd電池)があったり、劣化が早まったり(Liイオン電池)などしますが、この鉛蓄電池は満充電をキープしておくことが長持ちさせる秘訣です。なので、普段充電しっぱなしで、いざというときにだけ使うパソコン・サーバ・通信装置などのUPS(無停電電源)にはまだまだ現役なのです。 [3]シール鉛蓄電池について近年、シール鉛蓄電池という物が製品化されています。これは、電極(鉛)や電解液(希硫酸)等の構成や、充放電時に起こる化学反応は鉛蓄電池と同じですが、以下のような工夫により、補水が不要、置き方が基本的に自由といった特徴を持つものです。・充電により発生するガス(水素、酸素)は負極表面で水に還元する ・安全弁があり、急激に内圧が異常に高まった場合以外は液が漏れない ・電解液をガラス繊維に含侵させたりゲル状にしたりして、反応状態が姿勢に依存しないようにしている それでは、解答に移ります。 A…充電で繰り返し使えるのは二次電池です B…鉛蓄電池の1セルあたりの電圧は約2.0 [V]です C…鉛蓄電池の放電終止電圧は約1.8 [V]です となりますから、正解は5と分かります。 | |
 |
 |