| □ H20年04月期 A-18 Code:[HG0705] : リチウムイオン蓄電池の特性や他の蓄電池との比較 |
 検索サイトから来た方は… 無線工学の基礎 トップへ 以下をクリックすると、元のページが行き先に飛び、このウインドウは閉じます |
| ■ 無線工学を学ぶ |
|
(1) 無線工学の基礎 |
|
年度別出題一覧 |
| H11年 4月期,8月期,12月期 |
| H12年 4月期,8月期,12月期 |
| H13年 4月期,8月期,12月期 |
| H14年 4月期,8月期,12月期 |
| H15年 4月期,8月期,12月期 |
| H16年 4月期,8月期,12月期 |
| H17年 4月期,8月期,12月期 |
| H18年 4月期,8月期,12月期 |
| H19年 4月期,8月期,12月期 |
| H20年 4月期,8月期,12月期 |
| H21年 4月期,8月期,12月期 |
| H22年 4月期,8月期,12月期 |
| H23年 4月期,8月期,12月期 |
| H24年 4月期,8月期,12月期 |
| H25年 4月期,8月期,12月期 |
| H26年 4月期,8月期,12月期 |
| H27年 4月期,8月期,12月期 |
| H28年 4月期,8月期,12月期 |
| H29年 4月期,8月期,12月期 |
| H30年 4月期,8月期,12月期 |
| R01年 4月期,8月期,12月期 |
| R02年 4月期,9月期,12月期 |
| R03年 4月期,9月期,12月期 |
| R04年 4月期,8月期,12月期 |
| R05年 4月期,8月期,12月期 |
| R06年 4月期,8月期,12月期 |
|
分野別出題一覧 |
| A 電気物理, B 電気回路 |
| C 能動素子, D 電子回路 |
| E 送信機, F 受信機 |
| G 電源, H アンテナ&給電線 |
| I 電波伝搬, J 計測 |
| ■ サイトポリシー |
| ■ サイトマップ[1ama] |
| ■ リンクと資料 |
■ メールは下記まで |

|
| 2025年 |
| 03/31 R06/12月期問題頁掲載 |
| 03/31 R06/08月期問題頁掲載 |
| 03/31 R06/04月期問題頁掲載 |
| 03/31 R05/12月期問題頁掲載 |
| 03/31 R05/08月期問題頁掲載 |
| 03/31 R05/04月期問題頁掲載 |
|
|
| |||||||||||
| |||||||||||
リチウムイオン蓄電池は、携帯機器では一般的な電源になりましたが、ニカド電池のように電池単体では販売されていません。安全性の観点から、充電制御回路+電池本体がセットになった状態でしか手に入れることができないからです。このため、ハンディ機などでは長らく乾電池と互換形状のニカド(もしくはニッケル水素)電池が主流でした。しかし、これだけ一般に普及する技術になったので、無線の国家試験でも出題されるようになりました。まずは、よく比較されるニカド電池の知識から始めて、リチウムイオン蓄電池に迫ります。[1]ニッケルカドミウム電池(NiCd電池)の特徴と動作ニッケルカドミウム電池は、「ニカド電池(JIS)」「ニッカド電池」「カドニカ(三洋電機の商標名)」とか呼ばれるもので、ハンディ機などの電源としてよく使われていました。過去形なのは、ニッケル水素電池にその座を明け渡しつつあるからです。ニッケル水素の方が容量が大きく、カドミウムという環境負荷の大きな材料を使わないためですが、まだ現役で使われています。放電された状態では、負極が水酸化カドミウム(以下、Cd(OH)2)、正極が水酸化ニッケル(以下、Ni(OH)2)になっています。充電すると、負極がカドミウム(以下、Cd)、正極がオキシ水酸化ニッケル(以下、NiOOH)に変化します。電解液は、水酸化カリウムや水酸化ナトリウムなどの水溶液です。Fig.HG0705_aで動作を見ておきます。 | ||||||||||||||||||||||
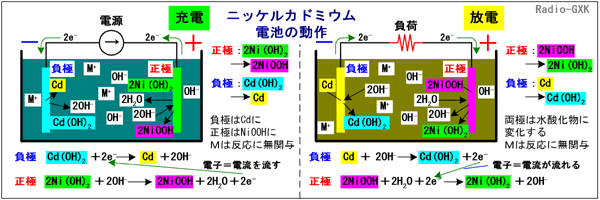 Fig.HG0705_a ニッケルカドミウム電池の動作原理 | ||||||||||||||||||||||
[2]リチウムイオン蓄電池の特徴と動作近年、ノートPCや携帯電話などに多く用いられるようになった電池です。軽量で容量が大きいため、これらの機器で長時間駆動ができますが、一旦(電池内部で)短絡事故になった場合に放出されるエネルギーも大きいので、電池自体に保護回路が入っているのが普通で、通常、単体では販売されていません。また、充電制御も必要なため、必ず機器の付属品として充電器が付いてくるか、あるいは充電器内蔵として、その機器専用に使われます。リチウムイオン電池は、他の二次電池と充放電の原理が少し違い、化学反応式で書くのが適当か分かりませんが、世間で採用されている表現で書いてみます。Fig.HG0705_bを見て下さい。 一般的なリチウムイオン電池では、正極にはコバルト酸リチウム(LiCoO2)、負極にはリチウムイオンを取込む特殊な構造をしたカーボン(C:炭素)、電解液には有機溶媒が用いられます。正極と負極の間には、セパレータと呼ばれる、リチウムイオンは通すが絶縁性のある膜が用いられ、正極と負極がショートしないようにしています。 | ||||||||||||||||||||||
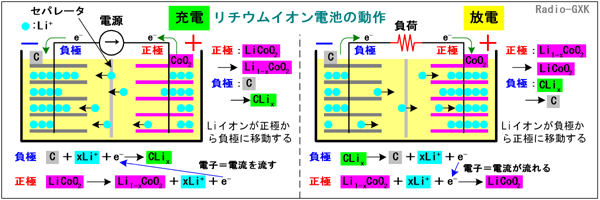 Fig.HG0705_b リチウムイオン電池の動作原理 | ||||||||||||||||||||||
[3]ニカド電池とリチウムイオン蓄電池の比較長々と説明してきましたが、国家試験が目的なら、下記のことをチェックしておけばよいでしょう。
| ||||||||||||||||||||||
|
それでは、解答に移ります。 1…リチウムイオン電池は自己放電量が少ないので正しい記述です 2…セル1個の起電力は、公称4.3 [V]程度ですので誤りです 3…リチウムイオン電池はメモリー効果がないので正しい記述です 4…今やモバイル機器の電源はほとんどこれであり、正しい記述です 5…リチウムイオン電池は「だらだら」な放電特性なので、正しい記述です となりますから、正解(誤った選択肢)は2と分かります。 | ||||||||||||||||||||||
 |
 |
|||||||||||||||||||||